메발론산 경로
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
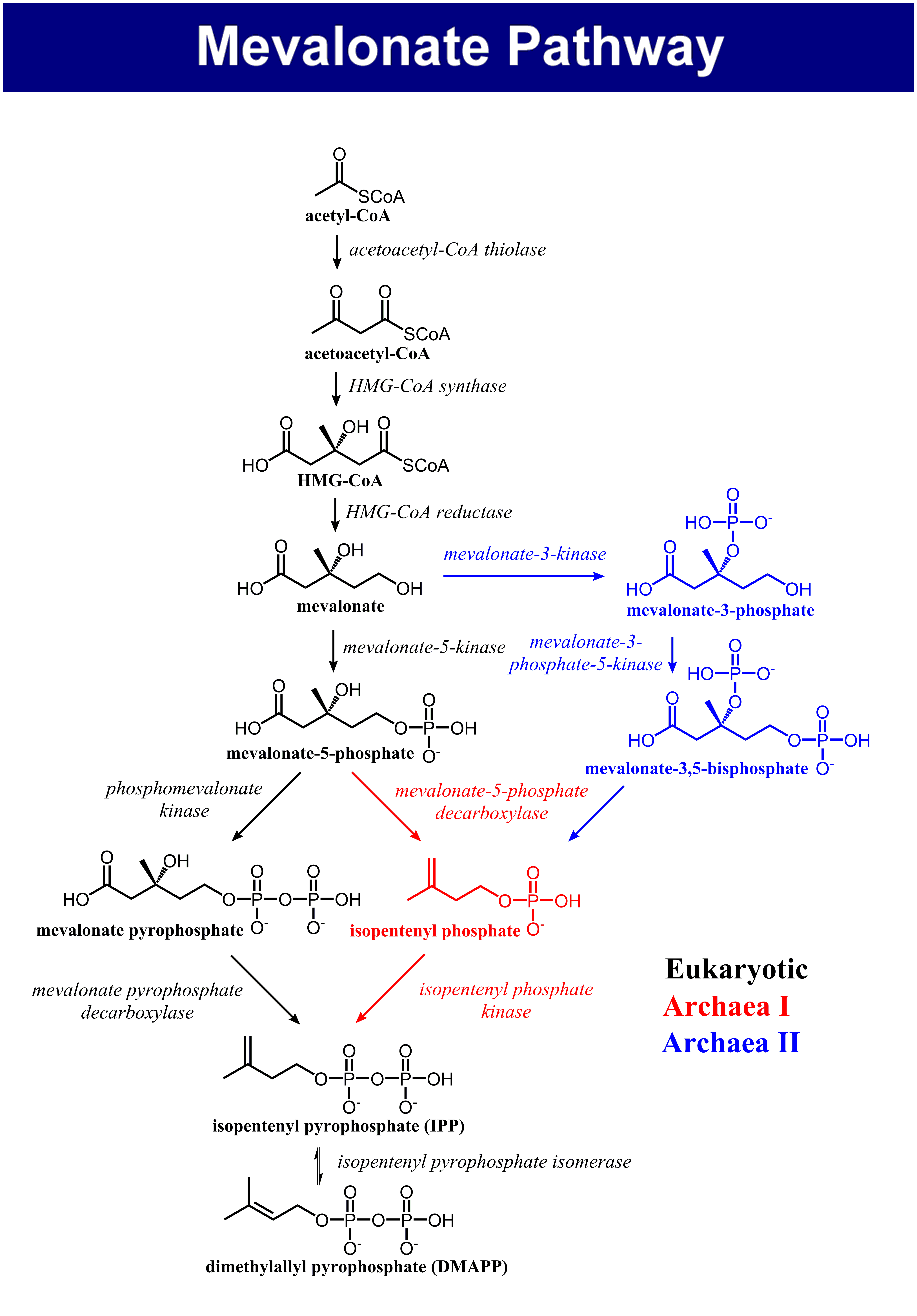
메발론산 경로는 아세틸-CoA로부터 메발론산을 생성하고, 메발론산을 활성화된 아이소프렌 단위로 전환하는 대사 경로이다. 이 경로는 진핵생물, 고균, 세균에서 아세틸-CoA를 사용하여 시작하며, HMG-CoA 환원효소는 콜레스테롤 합성의 속도 제한 단계로 스타틴과 같은 약물의 표적이 된다. 메발론산으로부터 아이소펜테닐 피로인산(IPP)과 다이메틸알릴 피로인산(DMAPP)으로의 전환은 진핵생물, 고균 경로 I, 고균 경로 II 등 3가지 경로로 이루어진다. 고세균은 4가지 변형 메발론산 경로를 가지며, 식물, 세균, 원생동물은 비메발론산 경로를 이용한다. 메발론산 경로는 콜레스테롤 수치 조절과 관련된 전사 및 번역 후 조절을 받으며, 스타틴, 비스포스포네이트와 같은 약물 표적이 된다. 메발론산 키네이스 결핍증과 같은 질환이 이 경로에 영향을 미치며, 모든 생물의 공통 조상(LUCA)이 메발론산 경로를 가졌을 가능성이 높다.
2. 아세틸-CoA로부터 메발론산의 생성 (상위 메발론산 경로)
메발론산 경로는 진핵생물, 고균, 세균에서 모두 같은 방식으로 시작된다. 메발론산 경로의 유일한 탄소 공급원은 아세틸-CoA이다. 첫 번째 단계는 싸이올레이스에 의해 2분자의 아세틸-CoA를 축합시켜 아세토아세틸-CoA를 생성하는 것이다. 이어서 아세토아세틸-CoA와 아세틸-CoA가 HMG-CoA 생성효소에 의해 축합되어 β-하이드록시 β-메틸글루타릴-CoA(HMG-CoA)를 형성하는 반응이 일어난다. 다음으로 HMG-CoA 환원효소에 의한 HMG-CoA의 환원으로 메발론산을 생성한다. 이 처음 3가지 효소 반응 단계를 상부 메발론산 경로라고 한다.
진핵생물이 갖는 경로는 3개의 효소 반응으로 이루어지며 다음과 같다.
HMG-CoA 환원효소에는 두 종류가 있다. 타입 1 (EC1.1.1.34)은 보조 효소로 NADPH를 이용하는 반면, 타입 2 (EC1.1.1.88)는 NADH를 이용한다.
2. 1. 아세토아세틸-CoA 생성
메발론산 경로는 진핵생물, 고균, 세균에서 모두 같은 방식으로 시작되며, 유일한 탄소 공급원은 아세틸-CoA이다. 첫 번째 단계는 싸이올레이스에 의해 2분자의 아세틸-CoA를 축합시켜 아세토아세틸-CoA를 생성하는 것이다.
2. 2. β-하이드록시 β-메틸글루타릴-CoA (HMG-CoA) 생성
메발론산 경로는 진핵생물, 고균, 세균에서 모두 같은 방식으로 시작된다. 메발론산 경로의 유일한 탄소 공급원은 아세틸-CoA이다. 첫 번째 단계는 싸이올레이스에 의해 2분자의 아세틸-CoA를 축합시켜 아세토아세틸-CoA를 생성하는 것이다. 이어서 아세토아세틸-CoA와 아세틸-CoA가 HMG-CoA 생성효소에 의해 축합되어 β-하이드록시 β-메틸글루타릴-CoA(HMG-CoA)를 형성하는 반응이 일어난다. 다음으로 HMG-CoA 환원효소에 의한 HMG-CoA의 환원으로 메발론산을 생성한다.진핵생물이 갖는 경로는 다음과 같으며, 7개의 효소 반응으로 이루어진다.
이 중 세 번째 효소인 HMG-CoA 환원효소에는 두 종류가 있다. 타입 1 (EC1.1.1.34)은 보조 효소로 NADPH를 이용하는 데 반해, 타입 2 (EC1.1.1.88)는 NADH를 이용한다.
2. 3. 메발론산 생성
메발론산 경로는 진핵생물, 고균, 세균에서 모두 같은 방식으로 시작된다. 메발론산 경로의 유일한 탄소 공급원은 아세틸-CoA이다. 첫 번째 단계는 싸이올레이스에 의해 2분자의 아세틸-CoA를 축합시켜 아세토아세틸-CoA를 생성하는 것이다. 이어서 아세토아세틸-CoA와 아세틸-CoA가 HMG-CoA 생성효소에 의해 축합되어 β-하이드록시 β-메틸글루타릴-CoA(HMG-CoA)를 형성하는 반응이 일어난다. 다음으로 HMG-CoA 환원효소에 의한 HMG-CoA의 환원으로 메발론산을 생성한다.진핵생물이 갖는 경로는 다음과 같으며, 7개의 효소 반응으로 이루어진다.
메발론산을 아이소펜테닐 피로인산(IPP)과 다이메틸알릴 피로인산(DMAPP)으로 전환시키는 경로는 세 가지가 있다. 진핵생물에서는 메발론산의 5번 탄소의 하이드록시기에서 두 번 인산화된 후 탈카복실화되어 아이소펜테닐 피로인산이 생성된다. 일부 고균에서는 5번 탄소의 하이드록시기에서 한 번 인산화 및 탈카복실화 과정을 거쳐 아이소펜테닐 인산(IP)을 생성하고, 이후 다시 인산화되어 IPP를 생성한다(고균의 메발론산 경로 I). 또 다른 고균의 메발론산 경로는 3번 탄소의 하이드록시기에서 인산화된 후, 5번 탄소의 하이드록시기에서 인산화된다. 생성된 대사산물인 메발론산 3,5-이중인산은 탈카복실화되어 IP가 된 후, 인산화되어 IPP를 생성한다(고균의 메발론산 경로 II). 이 경로는 테르모플라스마 아치도필룸에서 발견되었다.
이 중 두 효소에 대해, 실제로는 기능적으로 동등한 복수의 효소가 존재하며, 생물종에 따라 보유하고 있는 조합이 다르다.
먼저, 세 번째 효소인 HMG-CoA 환원효소에는 두 종류(타입 1과 타입 2)가 있다. 타입 1 (EC1.1.1.34)은 보조 효소로 NADPH를 이용하는 데 반해, 타입 2 (EC1.1.1.88)는 NADH를 이용한다. 생물계에서의 양자의 분포는 복잡하며, 근연종이라도 다른 타입을 가지고 있는 경우가 있다. 타입 1 및 타입 2는 아미노산 서열이 상동이며, 공통 조상으로부터 분기되어 서로 독립적으로 진화했다고 생각된다.
마찬가지로, 메발론산 경로의 마지막 효소인 이소펜테닐 이인산 이소머라제에도 두 종류([http://www.jbsoc.or.jp/seika/wp-content/uploads/2013/05/83-04-04.pdf 타입 1과 타입 2])가 존재한다. 이쪽도 분포는 복잡하며, 근연종이라도 다른 타입을 가지고 있는 경우가 있다. 이쪽은 양 타입에 아미노산 서열의 상동성은 보이지 않는다.
3. 메발론산으로부터 활성화된 아이소프렌 단위로의 전환 (하위 메발론산 경로)
메발론산 합성에 이르는 경로는 세 개의 도메인에서 비교적 잘 보존되어 있지만, 메발론산 이후 경로는 도메인 간, 도메인 내에서도 차이를 보인다. 메발론산 이후의 효소 반응은 대부분 상동적인 효소군(GHMP 효소 패밀리)에 의해 촉매되며, 이 효소군의 기능적 다양화가 각 도메인에서 여러 번 일어났다고 추측된다.
3. 1. 진핵생물 경로
메발론산을 아이소펜테닐 피로인산(IPP)과 다이메틸알릴 피로인산(DMAPP)으로 전환시키는 경로는 3가지가 있다. 진핵생물에서 메발론산은 5번 탄소의 하이드록시기에서 두 번 인산화된 후 탈카복실화되어 아이소펜테닐 피로인산이 생성된다.
진핵생물의 메발론산 경로는 7개의 효소 반응으로 이루어진다.
이 중 두 효소는 기능적으로 동등한 복수의 효소가 존재하며, 생물종에 따라 보유하고 있는 조합이 다르다.
HMG-CoA 환원효소에는 두 종류(타입 1과 타입 2)가 있다. 타입 1 (EC1.1.1.34)은 보조 효소로 NADPH를 이용하는 반면, 타입 2 (EC1.1.1.88)는 NADH를 이용한다. 생물계에서 타입 1과 타입 2의 분포는 복잡하며, 근연종이라도 다른 타입을 가지고 있는 경우가 있다. 타입 1 및 타입 2는 아미노산 서열이 상동이며, 공통 조상으로부터 분기되어 서로 독립적으로 진화했다고 생각된다.
메발론산 경로의 마지막 효소인 이소펜테닐 이인산 이소머라제에도 두 종류([http://www.jbsoc.or.jp/seika/wp-content/uploads/2013/05/83-04-04.pdf 타입 1과 타입 2])가 존재한다. 이소펜테닐 이인산 이소머라제 타입 1과 타입 2의 분포는 복잡하며, 근연종이라도 다른 타입을 가지고 있는 경우가 있다. 두 타입은 아미노산 서열의 상동성이 보이지 않는다.
3. 2. 고균 경로 I
진핵생물에서 메발론산은 5번 탄소의 하이드록시기에서 두 번 인산화된 후 탈카복실화되어 아이소펜테닐 피로인산(IPP)이 생성된다. 일부 고균에서 메발론산은 5번 탄소의 하이드록시기에서 한 번 인산화되고, 탈카복실화되어 아이소펜테닐 인산(IP)을 생성하며, 다시 인산화되어 IPP를 생성한다. 이러한 고균 경로는 할로페락스 볼카니(''Haloferax volcanii'')에서 발견되었다.3. 3. 고균 경로 II
테르모플라스마 아키도필룸(''Thermoplasma acidophilum'')에서 발견된 고균의 메발론산 경로는 메발론산의 3번 탄소의 하이드록시기에서 인산화된 다음, 5번 탄소의 하이드록시기에서 인산화된다. 이러한 결과로 생성되는 대사산물인 메발론산 3,5-이중인산은 탈카복실화되어 아이소펜테닐 인산(IP)이 된 다음, 인산화되어 아이소펜테닐 피로인산(IPP)을 생성한다(고균의 메발론산 경로 II).메발론산 경로 중 메발론산의 합성에 이르는 경로는 세 개의 모든 도메인에서 비교적 잘 보존되어 있는 반면, 메발론산 이후는 도메인 간, 그리고 도메인 내에서도 차이를 보인다. 메발론산 이후의 효소 반응은 대부분 서로 상동적인 효소군(GHMP 효소 패밀리)에 의해 촉매되며, 이 효소군의 기능적 다양화가 각 도메인에서 여러 번 일어났다고 추측된다.
3. 4. 아이소펜테닐 피로인산(IPP)과 다이메틸알릴 피로인산(DMAPP)의 상호전환
메발론산을 아이소펜테닐 피로인산(IPP)과 다이메틸알릴 피로인산(DMAPP)으로 전환시키는 경로는 세 가지가 있다. 진핵생물에서는 메발론산의 5번 탄소의 하이드록시기에서 두 번 인산화되고 탈카복실화되어 아이소펜테닐 피로인산이 생성된다. 할로페락스 볼카니(''Haloferax volcanii'')와 같은 일부 고균에서 메발론산은 5번 탄소의 하이드록시기에서 한 번 인산화되고, 탈카복실화되어 아이소펜테닐 인산(IP)을 생성하고, 이 후에 다시 인산화되어 아이소펜테닐 피로인산(IPP)을 생성한다(고균의 메발론산 경로 I). 테르모플라스마 아치도필룸(''Thermoplasma acidophilum'')에서 발견된 고균의 또 다른 메발론산 경로는 메발론산의 3번 탄소의 하이드록시기에서 인산화된 다음, 5번 탄소의 하이드록시기에서 인산화된다. 이러한 결과로 생성되는 대사산물인 메발론산 3,5-이중인산은 탈카복실화되어 아이소펜테닐 인산(IP)이 된 다음, 인산화되어 아이소펜테닐 피로인산(IPP)을 생성한다(고균의 메발론산 경로 II).진핵생물이 갖는 경로는 다음과 같으며, 7개의 효소 반응으로 이루어진다.
이 중 두 효소에 대해, 실제로는 기능적으로 동등한 복수의 효소가 존재하며, 생물종에 따라 보유하고 있는 조합이 다르다.
먼저, 세 번째 효소인 HMG-CoA 환원효소에는 타입 1 (EC1.1.1.34)과 타입 2 (EC1.1.1.88)의 두 종류가 있다. 타입 1은 보조 효소로 NADPH를 이용하는 데 반해, 타입 2는 NADH를 이용한다. 생물계에서의 양자의 분포는 복잡하며, 근연종이라도 다른 타입을 가지고 있는 경우가 있다. 타입 1 및 타입 2는 아미노산 서열이 상동이며, 공통 조상으로부터 분기되어 서로 독립적으로 진화했다고 생각된다.
마찬가지로, 메발론산 경로의 마지막 효소인 이소펜테닐 이인산 이소머라제에도 타입 1과 타입 2의 두 종류([http://www.jbsoc.or.jp/seika/wp-content/uploads/2013/05/83-04-04.pdf])가 존재한다. 이쪽도 분포는 복잡하며, 근연종이라도 다른 타입을 가지고 있는 경우가 있다. 이쪽은 양 타입에 아미노산 서열의 상동성은 보이지 않는다.
4. 변형 메발론산 경로 (고균)
고세균에는 진핵생물 및 세균이 가지는 메발론산 경로와는 별개로, 일부 경로가 다른 변형된 메발론산 경로가 복수로 존재한다.[3] 대부분의 고세균이 가지는 메발론산 경로가 완전히 해명된 것은 매우 최근이다.
고세균에는 현재 4종류의 메발론산 경로가 확인되어 있다. 이 중 루트 1은 대부분의 고세균에 분포하고 있으며, 적어도 고세균의 공통 조상까지 기원이 거슬러 올라간다고 생각된다. 나머지 3개(루트 2, 3, 4)는 고세균의 제한된 계통에서만 발견되며, 이들은 수평 유전자 이동에 의해 비교적 새로운 시대에 도입된 것으로 생각된다.
메발론산 경로 중 메발론산의 합성에 이르는 경로는 세 개의 모든 도메인에서 비교적 잘 보존되어 있는 반면, 메발론산 이후는 도메인 간, 그리고 도메인 내에서도 차이를 보인다.[3] 메발론산 이후의 효소 반응은 대부분 서로 상동적인 효소군(GHMP 효소 패밀리)에 의해 촉매되며, 이 효소군의 기능적 다양화가 각 도메인에서 여러 번 일어났다고 추측된다.[3]
진핵생물 및 세균의 메발론산 경로에서는, 메발론산으로부터 아이소펜테닐 이인산(IPP)까지의 3가지 효소 반응은 모두 상동적인 효소군(GHMP 효소 패밀리)에 의해 촉매된다. 한편, 대부분의 고세균이 가지는 변형 메발론산 경로(루트 1, 무수 포스포메발론산 경유)에서는 포스포메발론산으로부터 아이소펜테닐 이인산까지의 구간은 진핵생물·세균과는 별도의 루트로, 2개의 비GHMP 효소에 의해 촉매된다.[3] 따라서 3개의 도메인 모두에서 보존되어 있는 GHMP 효소는 메발론산 키나아제뿐이다. 그 때문에, 진핵생물·세균의 메발론산 경로에 있어서의 다른 GHMP 효소는, 메발론산 키나아제로부터 기능적으로 분기했을 가능성이 있다.[3] 한편, 고세균이 가지는 몇몇 변형 메발론산 경로(루트 2 및 3)도, 각 루트의 분기는 모두 메발론산의 합성 이후이며, 각각 다른 GHMP 효소가 관여한다. 그 때문에, 이들 고세균이 가지는 복수의 GHMP 효소도 메발론산 키나아제로부터 기능적으로 분기하여 성립했을 가능성이 있다.[3]
4. 1. 루트 1
고세균에는 현재 4종류의 메발론산 경로가 확인되어 있다. 이 중 하나는 대부분의 고세균에 분포하고 있으며, 적어도 고세균의 공통 조상까지 기원이 거슬러 올라간다고 생각된다(루트 1). 이 경로는 먼저 첫 번째 효소 반응이 같은 효소 그룹(티올라아제)에 속하지만, 티올라아제 II와는 별개의 효소에 의해 촉매된다. 또한, 5-포스포메발론산에서 이소펜테닐 이인산에 이르는 부분이, 다른 효소 반응에 의해 다른 중간체를 거쳐 3단계로 진행된다. 5-포스포메발론산은 먼저 탈수효소에 의해 무수 5-포스포메발론산이 되고, 이어서 탈탄산효소에 의해 이소펜테닐 일인산이 된다. 마지막으로 인산화 효소에 의해 이소펜테닐 이인산이 생성된다.4. 2. 루트 2
루트 2에서는 5-포스포메발론산이 탈탄산 효소에 의해 한 단계로 이소펜테닐 일인산으로 변환되고, 이어서 인산화 효소에 의해 이소펜테닐 이인산이 생성된다. 이 경로는 할로박테리아에서만 발견된다. 한편, 세균인 클로로플렉서스에서도 이 경로가 발견된다.4. 3. 루트 3
루트 3에서는 메발론산에서 인산화를 통해 3-포스포메발론산을 생성하고, 추가적인 인산화를 통해 3,5-비스포스포메발론산을 생성한다. 이어서 탈탄산화에 의해 이소펜테닐 일인산을 생성하고, 루트 1·2와 같은 인산화 효소에 의해 이소펜테닐 이인산이 생성된다. 이 경로는 주로 테르모플라스마강에 국한된다.4. 4. 루트 4
고세균에는 현재 4종류의 메발론산 경로가 확인되어 있다. 이 중 3개(루트 2, 3, 4)는 고세균의 제한된 계통에서만 발견되며, 이들은 수평 유전자 이동에 의해 비교적 새로운 시대에 도입된 것으로 생각된다. 진핵생물·세균 타입의 메발론산 경로(루트 4)도 설폴로부스목에 거의 국한되어 발견된다. 이것은 진핵생물 또는 세균으로부터 유래된 것으로 보인다.5. 비메발론산 경로 (MEP 경로)
식물, 대부분의 세균, 말라리아 원충과 같은 일부 원생생물은 비메발론산 경로(메틸에리트리톨 인산(MEP) 경로)를 사용하여 아이소프레노이드를 생성한다. 메발론산 경로와 비메발론산 경로의 생성물은 둘 다 아이소펜테닐 피로인산(IPP)과 다이메틸알릴 피로인산(DMAPP)으로 동일하지만, 아세틸-CoA를 아이소펜테닐 피로인산으로 전환시키는 효소 반응은 완전히 다르다. 고등 식물에서 비메발론산 경로는 색소체에 존재하며, 메발론산 경로는 세포질에 존재한다. 비메발론산 경로를 가지고 있는 세균의 예로는 대장균 및 결핵균과 같은 병원균이 있다. 두 대사 경로 간의 상호 작용은 13C-포도당 동위체를 사용하여 연구할 수 있다.[2]
6. 메발론산 경로의 조절
메발론산 경로는 SREBP (스테롤 조절 요소 결합 단백질-1 및 -2) 활성화를 통한 DNA 전사 조절로 여러 핵심 효소들을 활성화한다. 세포 내 센서는 낮은 콜레스테롤 수치를 감지하여 HMG-CoA 환원효소 경로를 통한 내생적 생산을 자극하고, LDL 수용체를 늘려 지단백질 흡수를 증가시킨다. 이 경로는 mRNA 번역 속도, 환원효소 분해 및 인산화 조절을 통해 제어된다.
6. 1. 전사 조절
몇몇 핵심 효소는 스테롤 조절요소 결합 단백질(SREBP) 활성화에 대한 DNA 전사 조절을 통해 활성화될 수 있다. 이러한 세포 내 센서는 낮은 콜레스테롤 수치를 감지하여 메발론산 경로에 의한 내인성 생성을 자극할 뿐만 아니라 LDL 수용체를 상향 조절함으로써 지질단백질의 흡수를 증가시킨다. 또한 메발론산 경로의 조절은 mRNA의 번역 속도, 환원효소의 분해 및 인산화를 조절함으로써 달성된다.6. 2. 번역 후 조절
몇몇 핵심 효소는 스테롤 조절요소 결합 단백질(SREBP) 활성화에 대한 DNA 전사 조절을 통해 활성화될 수 있다. 이러한 세포 내 센서는 낮은 콜레스테롤 수치를 감지하여 메발론산 경로에 의한 내인성 생성을 자극할 뿐만 아니라 LDL 수용체를 상향 조절함으로써 지질단백질의 흡수를 증가시킨다. 또한 메발론산 경로의 조절은 mRNA의 번역 속도, 환원효소의 분해 및 인산화를 조절함으로써 달성된다.7. 메발론산 경로를 표적으로 하는 약물
스타틴과 비스포스포네이트를 포함한 여러 약물들이 메발론산 경로를 표적으로 삼는다.[1] 스타틴은 HMG-CoA 환원 효소를 억제하여 콜레스테롤 합성을 줄인다. 비스포스포네이트는 파네실 피로인산 합성 효소를 저해하여 파골 세포의 세포 자멸사를 유도한다.
7. 1. 스타틴 (Statin)
많은 약물들이 메발론산 경로를 표적으로 삼는다.[1]스타틴은 메발론산 경로의 속도 제한 단계인 HMG-CoA 환원 효소를 경쟁적으로 저해하여 콜레스테롤 합성을 감소시킨다.[1] 비스포스포네이트(특히 아미노비스포스포네이트)는 파골 세포에 흡수되면 메발론산 경로의 하류에서 단백질의 프레닐화에 관여하는 파네실 피로인산을 합성하는 효소 (파네실 피로인산 합성 효소)를 저해한다.[1] 그로 인해 GTPase와 같은 세포 신호에 관여하는 단백질의 번역 후 변형을 저해함으로써 파골 세포의 세포 자멸사를 유도하고 골대사를 억제한다.[1]
7. 2. 비스포스포네이트 (Bisphosphonate)
비스포스포네이트는 골다공증과 같은 다양한 골-퇴행성 질환의 치료에 사용되는 약물이다.[1] 비스포스포네이트(특히 아미노비스포스포네이트)는 파골 세포에 흡수되면 메발론산 경로의 하류에서 단백질의 프레닐화에 관여하는 파네실 피로인산을 합성하는 효소(파네실 피로인산 합성 효소)를 저해한다. 그로 인해 GTPase와 같은 세포 신호에 관여하는 단백질의 번역 후 변형을 저해함으로써 파골 세포의 세포 자멸사를 유도하고 골대사를 억제한다.8. 메발론산 경로 관련 질환
메발론산 경로에 영향을 미치는 질환으로 메발론산 키네이스 결핍증이 있으며, 세부 질환으로는 메발론산뇨증과 면역글로불린 D 증후군(HIDS)이 있다.[1]
8. 1. 메발론산 키네이스 결핍증
메발론산 키네이스 결핍증은 메발론산 경로에 영향을 미치는 질병이다.[1] 세부 질환으로는 메발론산뇨증과 면역글로불린 D 증후군(HIDS)이 있다.[1]9. 메발론산 경로의 진화
메발론산 경로는 진핵생물과 고세균에 거의 보편적으로 분포한다. 반면 세균 내에서의 분포는 제한적이다(세균의 대부분은 비메발론산 경로를 가진다). 그러나 비메발론산 경로와 달리 메발론산 경로는 3개의 모든 도메인에 분포하고 있으며, 분자 계통 분석 결과, 메발론산 경로를 구성하는 복수의 효소의 진화 계통수에서 각 도메인이 별개의 클레이드를 형성하는 것으로부터, 모든 생물의 공통 조상(LUCA)은 메발론산 경로를 가지고 있었다고 추정되었다[7]。 이 경우 진핵생물 및 고세균은 메발론산 경로를 공통 조상 시대부터 현재까지 유지하고 있는 반면, 세균에서는 비메발론산 경로가 새롭게 진화하여, 일부 세균만이 본래의 메발론산 경로를 유지하고 있게 된다. 그러나 실제로는 진핵생물과 고세균에서는 경로의 일부가 다른 반면[3], 거꾸로 진핵생물과 세균에서는 보유하는 메발론산 경로가 동일하다. 실제로, 보다 최근의 분자 계통 분석에서는, 진핵생물의 메발론산 경로는 고세균이 아닌 세균 유래(유전자 수평 전달)라고 추정되고 있다[8]。 어느 쪽이든, LUCA가 메발론산 경로 자체를 이미 보유하고 있었을 가능성은 높다. 다만, LUCA가 가지고 있던 경로는 잘 알려진 진핵생물이 가지는 경로와는 메발론산 이후의 부분이 달랐을 가능성이 있다.
진핵생물 및 세균의 메발론산 경로에서는, 메발론산으로부터 아이소펜테닐 이인산 (IPP)까지의 3가지 효소 반응은 모두 상동적인 효소군(GHMP 효소 패밀리)에 의해 촉매된다. 한편, 대부분의 고세균이 가지는 변형 메발론산 경로(루트 1, 무수 포스포메발론산 경유)에서는 포스포메발론산으로부터 아이소펜테닐 이인산까지의 구간은 진핵생물·세균과는 별도의 루트로, 2개의 비GHMP 효소에 의해 촉매된다[3]。 따라서, 3개의 도메인 모두에서 보존되어 있는 GHMP 효소는 메발론산 키나아제뿐이다. 그 때문에, 진핵생물·세균의 메발론산 경로에 있어서의 다른 GHMP 효소는, 메발론산 키나아제로부터 기능적으로 분기했을 가능성이 있다. 한편, 고세균이 가지는 몇몇 변형 메발론산 경로(루트 2 및 3)도, 각 루트의 분기는 모두 메발론산의 합성 이후이며, 각각 다른 GHMP 효소가 관여한다. 그 때문에, 이들 고세균이 가지는 복수의 GHMP 효소도 메발론산 키나아제로부터 기능적으로 분기하여 성립했을 가능성이 있다. GHMP 효소 패밀리에 속하는 효소는, 비메발론산 경로에서도 발견되고 있으며(4-디포스포시티딜-2-C-메틸-D-에리트리톨 키나아제;IspE), 이 효소 패밀리의 기원은 아이소프레노이드 생합성과 같거나 그 이전으로 거슬러 올라간다고 생각된다.
덧붙여, 메발론산 경로의 최초 2개의 효소인 티올라아제와 HMG-CoA 합성효소도 서로 상동적이며 진화적으로 관련되어 있다. 다만, 각각의 출현 시기에 대해서는 현재로서는 알려져 있지 않다. 티올라아제는 아이소프레노이드 생합성뿐만 아니라, 복수의 대사 경로에 관여하고(티올라아제 I 등) 있기에, HMG-CoA 합성효소는 이미 존재하고 있던 티올라아제 효소 패밀리 중에서 진화했을 가능성이 있다.
참조
[1]
논문
Bisphosphonates for the treatment of osteoporosis: insights for clinicians
2010-05-00
[2]
논문
Metabolic flux ratio analysis by parallel 13C labeling of isoprenoid biosynthesis in ''Rhodobacter sphaeroides''
[3]
논문
Modified mevalonate pathway of the archaeon Aeropyrum pernix proceeds via trans -anhydromevalonate 5-phosphate
http://www.pnas.org/[...]
2018-10-02
[4]
논문
Discovery of a metabolic alternative to the classical mevalonate pathway
https://elifescience[...]
2013-12-10
[5]
논문
(R)-Mevalonate 3-Phosphate Is an Intermediate of the Mevalonate Pathway in Thermoplasma acidophilum
https://linkinghub.e[...]
2014-06-00
[6]
논문
Biochemical evidence supporting the presence of the classical mevalonate pathway in the thermoacidophilic archaeon Sulfolobus solfataricus
https://academic.oup[...]
2013-05-00
[7]
논문
Origins and Early Evolution of the Mevalonate Pathway of Isoprenoid Biosynthesis in the Three Domains of Life
https://academic.oup[...]
2011-01-01
[8]
논문
On the Origin of Isoprenoid Biosynthesis
https://academic.oup[...]
2018-09-01
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com